精密発酵でラクトフェリンを開発するTurtleTreeは今月、アメリカ食品医薬品局(FDA)から精密発酵ラクトフェリンについて「質問なし」のレターを受領したと発表した。
これは同社が2023年11月にGRAS自己認証を宣言してからの進展であり、精密発酵ラクトフェリンとしては世界初のGRAS認証取得となる。
【補足】FDAのレター公開まではタイムラグがあるため、現在のGRAS Inventoryにはまだ回答待ちの状態となっている(No.1219)。いずれ、レターを確認できるようになる。
アメリカでは、外部の専門家委員会による安全性評価を受け、企業がGRAS自己認証を宣言することで、FDAの審査なしに原料の販売が可能になる。
しかし、パーフェクトデイをはじめとして多くの精密発酵企業は、パートナー企業や消費者からの信頼を得るため、FDAの“お墨付き”となるGRAS認証の取得を目指しており、TurtleTreeもその方針を採った。
今年3月にはロバート・ケネディ・ジュニア厚生長官が、GRAS自己認証の「抜け穴を排除する」として制度見直しを指示し、業界に波紋を広げた。
この発言は、その時点でGRAS自己認証を宣言したステータスにある企業にとっては、不確実性を高めるものであり、TurtleTreeをはじめとする企業にとっては、正式なGRAS認証の早期取得がより重要となったのは間違いない。
さらに今年4月には、米厚生省(HHS)管轄のFDAを含む保健機関で大規模な人員整理が行われた。ケネディ厚生長官は約1万人のフルタイム職員の削減を発表しており、4月にはFDAの約3,500人が解雇された。
こうした人員削減に伴う審査遅延も懸念される中、TurtleTreeと、同じく精密発酵ホエイで3月に認可を取得したViviciは、不安定な制度環境下で、“駆け込み承認”を果たした企業と見ることもできる。
一方で、マーティ・マキャリーFDA長官は4月末の発言で「組織再編はしない」と述べており、必ずしも全審査業務が停滞するとは限らない可能性も考えられる。
今後注目されるのは、すでにGRAS自己認証を宣言し、FDAの回答を待つ企業群である。
一例として、精密発酵で卵白を開発するフィンランド企業Onego Bio、カゼインを開発するFermifyが挙げられ、審査の長期化は、スタートアップの収益化や資金調達計画に影響を与える可能性がある。
特に、3月のケネディ厚生長官の指示によりGRAS自己認証が撤回されるかもしれない中、それを「安心材料」と考えられない状況では、スタートアップにとっては販売戦略上の制約となる。
こうした中、TurtleTreeに関しては先月、自社ブランド製品を発売し、Foovoが前回の記事で懸念していたパートナー企業との製品化の遅れが一部解消された。
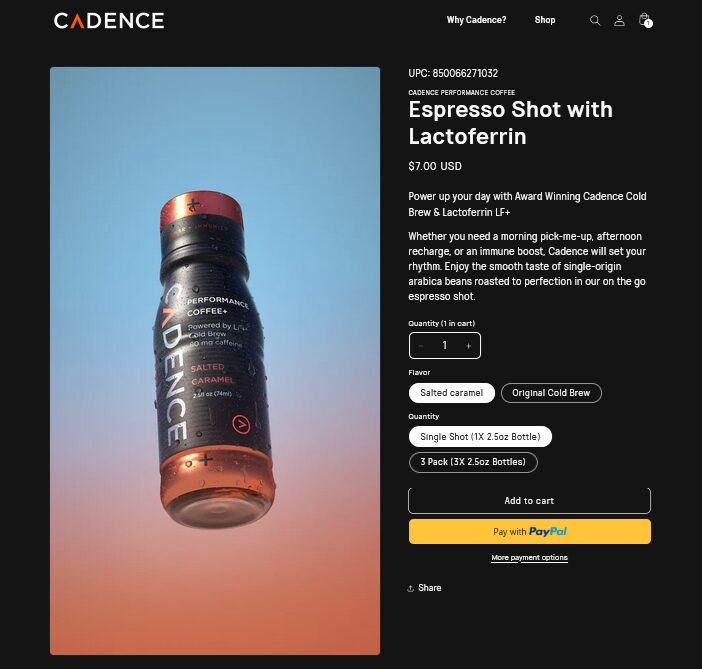
出典:Cadence 2025年5月27日時点で販売が確認されている
1年前に発表されたパートナー企業Cadence Performance Coffeeが、同社のラクトフェリン「LF+」を配合したエスプレッソドリンク(1本7ドル)を発売したことが確認された。現在オンラインで販売している(出荷先はアメリカ国内のみ)。
この動きは、TurtleTreeにとって前向きな材料であり、今回のGRAS認証とあわせて、今年後半に予定されている資金調達の成否を左右する一因となるだろう。
※本記事は、プレスリリースをもとに、Foovoの調査に基づいて独自に執筆したものです。出典が必要な情報については、記事内の該当部分にリンクを付与しています。
関連記事
アイキャッチ画像の出典:TurtleTree