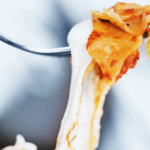
アメリカ、オレゴン州ポートランドの住民は、これまでにない新しいサーモンを味わう機会を得た。
培養サーモンを開発する米Wildtypeは2025年5月28日、アメリカ食品医薬品局(FDA)から「質問なし」のレターを受領し、同社の培養サーモンの販売が認められた。細胞培養によって製造されたサーモンの販売が認められるのは世界初の事例であり、同社はオレゴン州で先月末よりサーモンの提供を開始した。
2020年12月にシンガポールで世界初の培養肉がレストランに登場してから約4年半。培養シーフードの商業展開における最初の扉が、ついにアメリカで開かれた。
Wildtypeのプレスリリースによると、オレゴン州ポートランドにあるハイチ料理レストラン「Kann」では、5月末から培養サーモン料理の先行提供を開始した。6月は毎週木曜日に「Kann」で提供され、7月からは毎日提供へと段階的に拡大していく計画だ(予約はこちらから)。
同社によると、今後4ヶ月で4軒のレストランに導入が予定されている。
高級レストランを起点とした戦略

出典:Wildtype
Wildtypeは2016年に創業し、2021年には年産約22トン、将来的には最大90トンまで拡張可能なパイロット工場をサンフランシスコに開設。2021年12月には、寿司チェーンSNOWFOXやファストカジュアルレストランを運営するPokéworksと提携し、認可後の販売網の構築を進めてきた。
当時のプレスリリースでは、レストランチェーンや食料品店に先立ち、まず高級レストランに培養サーモンを導入すると明かしており、今回の「Kann」での提供開始は、その戦略の第一段階が現実となったことを示すものである。
同社は2022年2月にシリーズBラウンドで1億ドル(当時約114億円)を調達した。カーギル、俳優のレオナルド・ディカプリオ氏、シンガポール政府系ファンドのテマセクなどが参画し、培養シーフード業界において過去最大級の資金調達となった。その後、3年強を経て、FDAから安全性に問題がないことが確認された。
FDAが従来サーモンと同等に安全と認める

出典:Wildtype
FDAによると、Wildtypeが提出した資料(CCC 000005)に基づき、今回の食品は稚魚段階におけるコーホーサーモン(Oncorhynchus kisutch)の筋肉および結合組織から採取した間葉系細胞に由来し、安全性に問題はないと判断された。細胞は懸濁培養で増殖され、糖水溶液で洗浄後、急速冷却し冷凍保管される。従来のサーモンと比較して、脂肪酸やアミノ酸、ミネラルなどの栄養成分に多少のばらつきはあるものの、一般に消費される食品で確認されたものと一致していた。

出典:Scientific memo CCC 005(page2)
FDAは製造工程、細胞株、使用物質、最終産物にいたるまでを精査し、従来のサーモンと同等に安全と認めた(Scientific memo CCC 005 p1-2)。なお、アメリカでは、培養肉の規制はFDAとUSDAが担当するのに対し、ナマズ類を除く培養魚の規制監督権限はFDAのみが有する。
後続企業の規制承認への道筋を拓く快挙

出典:Wildtype
Wildtypeはこれにより、GOOD Meat、Upside Foods、Mission Barnsに続き、FDAの市販前協議を完了した4社目の企業となった(Mission BarnsはUSDAの最終承認を待つ状況にある)。
とりわけ、世界で初めて培養魚の販売認可を取得した企業として、その意義は大きい。また、世界の安全性確認事例として、牛・豚・鶏に続き、サーモンが加わった点も重要だ。
今回の承認は、単にWildtypeの市場参入を可能にしただけでなく、BlueNaluをはじめとする培養シーフード企業にとって、アメリカにおける認可取得の道筋を具体的に示す重要な前例となった。初期からこの分野に参入していたFinless Foodsのように、現在では活動を確認できない企業も存在するなか、認可までのプロセスの長期化や不透明さは、培養肉業界への投資が減速する一因ともなり、これが淘汰の加速や事業継続の困難を招くなど、負のスパイラルを生じさせている。
そうした状況において、FDAが審査過程や判断の根拠を示す資料を公表したことは、後続の企業にとって申請準備の指針となる。今後の規制対応を見据えるスタートアップにとって、今回の事例は大きな前進であり、培養シーフード業界全体にとっても重要な一歩となる。
※本記事は、プレスリリースおよびFDAの公開情報など一次情報をもとに、Foovoの調査に基づいて独自に執筆したものです。出典が必要な情報については、記事内の該当部分にリンクを付与しています。
関連記事
アイキャッチ画像の出典:Wildtype