ロバート・ケネディ・ジュニア米保健福祉長官(出典:米保健福祉省)
ロバート・ケネディ・ジュニア米保健福祉長官が今年3月、「GRAS自己認証」システム廃止に向けた検討を呼びかけてから6ヶ月。
アメリカのGRAS自己認証制度の廃止に向けた新たな動きが確認された。
アメリカ食品医薬品局(FDA)は9月、GRAS(Generally Recognized as Safe)規則を改正し、GRASであるとされるヒト・動物向けの食品の使用について、GRAS通知の提出を義務付ける規制案(0910-AJ02)を、2025年春統一アジェンダに追加した。
この規制案が最終決定されると、GRAS自己認証制度は廃止され、新規食品の展開を目指す企業はFDAへのGRAS通知が義務付けられることとなる。一方、すでにFDAから「質問なし」のレターを受領している物質は免除となる。
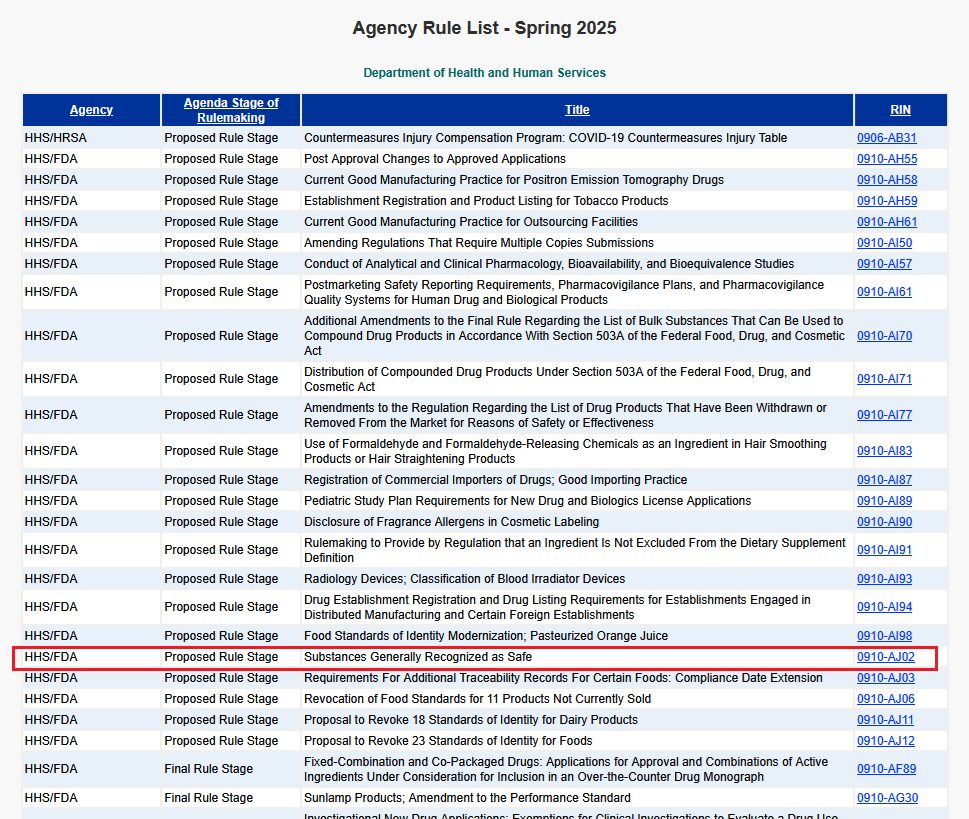
出典:Agency Rule List – Spring 2025
多くの精密発酵企業がGRAS自己認証にとどまらない理由

出典:Onego Bio
GRASとは、Generally Recognized As Safe(一般に安全とみなされている)の略語で、アメリカにおける食品安全に関する独自の認証制度をさす。
食品メーカーは精密発酵などの新規食品原料についてGRAS自己認証を宣言することで、当該原料を販売できるようになる。企業は、独自に選任した利益相反にならない外部の専門家委員による審査に基づき自己認定できるが、FDAへの通知は任意となる。
しかし、精密発酵を例にすれば、多くのスタートアップはGRAS自己認証にとどまらず、FDAに通知するGRAS認証を選択している。
このプロセスを経ることで、FDAが異議を唱えなければ「質問なし(No Questions)」のレターが発行され、より信頼性の高い市場参入が可能になるからだ。いわば、最高権威によるお墨付きを得るわけである。
たとえば、精密発酵企業パーフェクトデイも初期の頃から、GRAS認証はパートナー企業や消費者からの信頼を獲得し、市場に広く導入するための重要なステップとなると述べていた。
精密発酵で卵白を開発し、アメリカ進出を目指すOnego Bioも先月、Foovoによるメール取材に対し、「当社がFDAのGRAS通知を行うのは、当社がサービスの提供を目指す大手食品メーカーや消費財メーカーが最終的にこれを要求するためです」と述べている。
義務化の焦点:通知だけか、それともレター受領までか
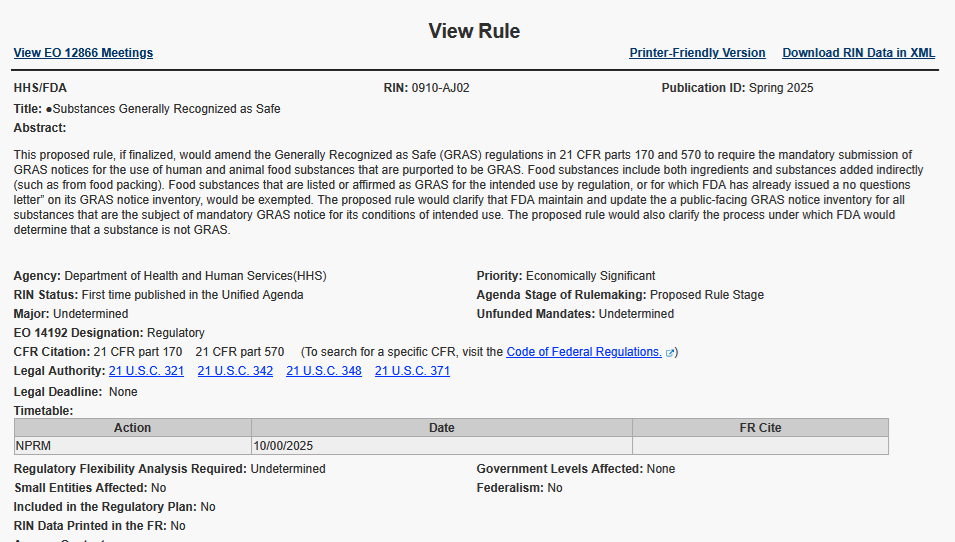
出典:0910-AJ02
上記規制案が決定されると、現在、GRAS自己認証により自社原料を市場に展開している企業は、FDAへのGRAS通知が義務付けられることとなる。
しかし、現在公開されているアジェンダ要旨からは、FDAへのGRAS通知までを義務付けるものなのか、あるいは「質問なし」のレターを得るまでは販売不可なのかは、明確な判断はできず、10月に予定される規則制定案公告(NPRM)を待たねばならない。
Foovoは後者、つまり「質問なし」のレターを受領できなければ販売不可になる可能性があるとみているが、アジェンダ要旨の下記文言からは、受理やプロセスの情報公開に重きを置いているようにも解釈でき、複数の解釈が生まれる可能性があるだろう。
アジェンダ要旨(0910-AJ02)より抜粋
The proposed rule would clarify that FDA maintain and update the a public-facing GRAS notice inventory for all substances that are the subject of mandatory GRAS notice for its conditions of intended use.
日本語訳
「本提案規則は、FDAが義務的なGRAS通知の対象となるすべての物質について、その意図された使用条件を含めた一般公開用GRAS通知インベントリを維持・更新することを明確化するものである」。
注意:インベントリへの掲載は通知の受理・公開を意味するのみで、No Questionsレターの受領を保証するものではない。レター発行に至らなかった事例も公開されている。
影響を受けるのは、これからアメリカで食品原料を展開したい企業、GRAS自己認証で食品原料を展開してきた企業だ。特に後者のGRAS自己認証により商品を展開している企業にとっては、必須になるのが通知までなのか、レター受領までなのかなど懸念材料が多い。
仮に最終規則で、FDAからのレター受領まで販売不可と定められた場合、通知準備から数ヵ月~1年程度にわたる審査期間は販売できなくなる可能性がある。その場合、どの程度の経過措置が認められるかが企業活動の行方を左右するだろう。
一方、Onego Bioのように最初から、FDAのレター取得を目指している企業にとっては大きな影響はないはずだ。
また、GRASは食品に使用される物質の安全性に関する制度となる。細胞培養したものが食品になる細胞性食品(培養肉など)は、FDAの市販前協議の対象となり、審査プロセスが異なるため、本改正案の影響は大きくないものと思われる。
ケネディ長官は今年3月、「あまりにも長い間、原料メーカーやスポンサーは抜け穴を利用して、安全性データが不明なことが多い新しい原料や化学物質を、FDAや国民に通知することなく米国の食品供給に導入してきました」と米保健福祉省(HHS)のプレスリリースで述べ、GRAS自己認証を「抜け穴」だと批判した。
その「抜け穴」を埋める動きが、2025年春統一アジェンダに追加された規制案となる。
※本記事は、規制案(0910-AJ02)をもとに、Foovoの調査に基づいて独自に執筆したものです。出典が必要な情報については、記事内の該当部分にリンクを付与しています。
関連記事
アイキャッチ画像の出典:米保健福祉省